ANSM - Mis à jour le : 08/02/2021
TYAVAX, suspension et solution pour suspension injectable en seringue préremplieVaccin de l'hépatite A (inactivé, adsorbé) et typhoïdique polyosidique Veuillez lire attentivement cette notice avant d’utiliser ce médicament car elle contient des informations importantes pour vous.· Gardez cette notice. Vous pourriez avoir besoin de la relire.
· Si vous avez d’autres questions, interrogez votre médecin, votre pharmacien ou votre infirmier/ère.
· Ce médicament vous a été personnellement prescrit. Ne le donnez pas à d’autres personnes.
· Si vous ressentez un quelconque effet indésirable, parlez-en à votre médecin, ou votre pharmacien ou votre infirmier/ère. Ceci s’applique aussi à tout effet indésirable qui ne serait pas mentionné dans cette notice. Voir rubrique 4.
2. Quelles sont les informations à connaître avant d'utiliser TYAVAX, suspension et solution pour suspension injectable en seringue préremplie ?
3. Comment utiliser TYAVAX, suspension et solution pour suspension injectable en seringue préremplie ?
4. Quels sont les effets indésirables éventuels ?
5. Comment conserver TYAVAX, suspension et solution pour suspension injectable en seringue préremplie ?
6. Contenu de l’emballage et autres informations.
Classe pharmacothérapeutique : Vaccins combinés bactériens et viraux - code ATC : J07CA10.
La fièvre typhoïde est une maladie infectieuse qui peut être transmise par des aliments ou boissons contenant les bactéries (appelées Salmonella enterica, sérotype typhi) qui causent la maladie. Il s'agit d'une infection grave qui peut être fatale si elle n'est pas rapidement traitée.
L'infection par l'hépatite A est due à un virus qui attaque le foie. Elle peut être transmise par des aliments ou boissons contenant le virus. La jaunisse et une sensation de malaise généralisé font partie des symptômes.
Quand vous recevez une injection de TYAVAX, les défenses naturelles de votre corps élaborent une protection contre la fièvre typhoïde et l'infection causée par le virus de l'hépatite A.
N’utilisez jamais TYAVAX, suspension et solution pour suspension injectable en seringue préremplie :·si vous êtes allergique à la (aux) substance(s) active(s) ou à l’un des autres composants contenus dans ce médicament, mentionnés dans la rubrique 6.
·si vous êtes allergique à la néomycine (antibiotique utilisé lors de la fabrication du vaccin et pouvant être présent dans celui-ci en petites quantités).
·si vous avez une maladie avec une température élevée. La vaccination doit être différée après la guérison.
Avertissements et précautionsAdressez-vous à votre médecin, pharmacien ou votre infirmier/ère avant d’utiliser TYAVAX.
·Si vous avez une faible réponse immunitaire parce que vous avez pris ou vous prenez un traitement susceptible d'affaiblir votre système immunitaire, comme les corticoïdes, les médicaments cytotoxiques ou la radiothérapie, votre médecin souhaitera peut-être attendre la fin du traitement.
·Si votre système immunitaire est déficient à cause d'une infection par le virus de l'immunodéficience humaine (VIH), il sera possible de vous administrer TYAVAX, mais le vaccin peut ne pas vous protéger aussi bien qu'il protège les personnes dont le système immunitaire fonctionne normalement.
·Ce vaccin ne protègera pas contre d'autres virus connus pour infecter le foie (comme les virus de l'hépatite B, l'hépatite C ou l'hépatite E). De même, si vous êtes déjà infecté(e) par le virus de l'hépatite A lors de l'administration de TYAVAX, la vaccination peut ne pas fonctionner correctement.
·Ce vaccin ne protègera pas contre les infections causées par des bactéries Salmonella autres que le type particulier responsable de la fièvre typhoïde.
·Ce vaccin ne peut pas causer les infections contre lesquelles il protège.
·Comme avec tous les vaccins, les personnes recevant TYAVAX ne seront pas toutes protégées de façon certaine contre l'hépatite A et la fièvre typhoïde.
·Un évanouissement peut survenir (surtout chez les adolescents) après, voire avant, toute injection avec une aiguille. Aussi, parlez-en à votre médecin ou infirmier(ère) si vous ou votre enfant vous êtes évanoui lors d’une précédente injection
Enfants et adolescentsUn évanouissement peut survenir (surtout chez les adolescents) après, voire avant, toute injection avec une aiguille. Aussi, parlez-en à votre médecin ou infirmier(ère) si vous ou votre enfant vous êtes évanoui lors d’une précédente injection.
Autres médicaments et TYAVAX, suspension et solution pour suspension injectable en seringue préremplieInformez votre médecin ou pharmacien si vous utilisez, avez récemment utilisé ou pourriez utiliser tout autre médicament.
Comme TYAVAX ne contient aucune bactérie ou aucun virus vivant, il peut, en général, être administré en même temps que d'autres vaccins, mais en un site d'injection différent (une autre partie du corps, comme l'autre bras ou une jambe). TYAVAX ne doit pas être mélangé à un autre vaccin dans une même seringue.
La protection obtenue en administrant TYAVAX en même temps que des immunoglobulines (anticorps obtenus à partir de dons du sang) n'a pas été évaluée. Si vous avez besoin d'une injection d'immunoglobulines, elle peut être administrée en même temps que TYAVAX ou quelques semaines après. Cependant il se peut que vous ne produisiez pas autant d'anticorps contre le virus de l'hépatite A qu'en temps normal, mais il est probable que vous soyez toutefois protégé(e) contre l'infection.
TYAVAX, suspension et solution pour suspension injectable en seringue préremplie avec des aliments, boissons et de l’alcoolSans objet.
Grossesse, allaitement et fertilitéSi vous êtes enceinte ou que vous allaitez, si vous pensez être enceinte ou planifiez une grossesse, demandez conseil à votre médecin ou pharmacien avant de prendre ce médicament.
Bien que TYAVAX ne soit pas supposé nuire au futur bébé, votre médecin ou votre infirmier/ère décidera si vous devez être vaccinée tout de suite ou après la naissance du bébé.
Conduite de véhicules et utilisation de machinesCe vaccin a une influence mineure sur l'aptitude à conduire des véhicules et à utiliser des machines.
Des cas de vertige ayant été rapportés chez certaines personnes (moins d'1 sur 100 mais plus d'1 sur 1000) après administration de TYAVAX, il convient donc d'être prudent si vous conduisez un véhicule ou utilisez une machine.
TYAVAX contient de la phénylalanine, de l’éthanol, du potassium et du sodiumTYAVAX contient 10 microgrammes de phénylalanine par dose de 1 mL équivalent à 0,17 microgrammes/kg chez une personne de 60 kg. La phénylalanine peut être dangereuse pour les personnes atteintes de phénylcétonurie (PCU), une maladie génétique rare caractérisée par l’accumulation de la phénylalanine ne pouvant être éliminée correctement.
TYAVAX contient 2 mg d’alcool (éthanol) par dose de 1 mL. La faible quantité d’alcool contenue dans ce médicament n’est pas susceptible d’entraîner d’effet notable.
TYAVAX contient moins de 1 mmol (39 mg) de potassium et moins de 1 mmol (23 mg) de sodium par dose, c’est-à-dire qu’il est essentiellement « sans potassium » et « sans sodium ».
Veillez à toujours utiliser ce médicament en suivant exactement les instructions de cette notice ou les indications de votre médecin, pharmacien ou infirmier/ère. Vérifiez auprès de votre médecin, pharmacien ou infirmier/ère en cas de doute.
PosologieLa dose recommandée est d'un millilitre de vaccin mélangé, aux personnes âgées de 16 ans et plus. La protection initiale est atteinte avec une seule dose de vaccin.
Ce vaccin commencera à vous protéger contre l'hépatite A environ 14 jours après la première dose. Vous aurez besoin d'une deuxième injection (rappel) de vaccin hépatite A inactivé pour obtenir une protection à long terme. Ce rappel vous protégera contre l'hépatite A au-delà de dix ans. La dose de rappel devra être administrée dans les 36 mois et de préférence dans les 6 à 12 mois après la première dose.
Ce vaccin peut vous être administré pour renforcer votre immunité vis-à-vis de l'hépatite A si vous avez déjà reçu une première dose de vaccin hépatite A inactivé 6 à 36 mois plus tôt, à condition que vous ayez également besoin d'une protection contre la fièvre typhoïde. Cependant, si la première dose de vaccin hépatite A a été administrée sous forme d'un vaccin typhoïdique et hépatite A combinés, alors la deuxième dose de vaccin combiné est habituellement administrée environ 36 mois après la première dose.
Ce vaccin commencera à vous protéger contre la fièvre typhoïde environ 14 jours après l'injection, et la protection peut durer environ 3 ans. Si, après 3 ans, il existe toujours un risque que vous contractiez la fièvre typhoïde, vous devez faire en sorte de recevoir une autre injection de vaccin typhoïdique polyosidique Vi.
Les liquides des deux compartiments doivent être mélangés dans la seringue juste avant l'injection. Une fois les liquides mélangés, votre médecin ou votre infirmier/ère agitera la seringue et s'assurera que le liquide est une suspension trouble blanchâtre et qu'aucune particule étrangère ne s'y trouve.
Mode et voie d'administrationCe vaccin vous sera administré en injection lente dans un muscle (voie intramusculaire (IM)) de la partie supérieure externe de votre bras. Votre médecin ou votre infirmier/ère évitera de vous injecter le vaccin dans la peau ou dans un vaisseau sanguin. Ce vaccin ne doit pas être administré dans la fesse.
Si vous souffrez d'hémophilie (maladie au cours de laquelle vous avez des bleus ou saignez facilement) ou de toute autre maladie qui implique que vous ne devez pas recevoir une injection dans le muscle, celle-ci peut se faire sous la peau.
Si vous avez utilisé plus de TYAVAX, suspension et solution pour suspension injectable en seringue préremplie que vous n’auriez dûConsultez immédiatement votre médecin ou votre pharmacien.
Dans certains cas, il a été utilisé plus que la dose recommandée. Dans ces cas, lorsque des effets indésirables ont été rapportés, ils étaient de même nature que ceux décrits dans la rubrique 4.
Si vous oubliez d’utiliser TYAVAX, suspension et solution pour suspension injectable en seringue préremplie Si vous arrêtez d’utiliser TYAVAX, suspension et solution pour suspension injectable en seringue préremplieSans objet.
Si vous avez d’autres questions sur l’utilisation de ce médicament, demandez plus d’informations à votre médecin, à votre pharmacien ou à votre infirmier/ère.
4. QUELS SONT LES EFFETS INDESIRABLES EVENTUELS ?
Des réactions allergiques graves ont été rapportées :
- Réaction allergique sévère (anaphylaxie), pouvant inclure un ou plusieurs des symptômes suivants :
·urticaire, éruptions cutanées,
·gonflement du visage et/ou du cou, difficulté à respirer, coloration bleue de la langue ou des lèvres,
·tension artérielle basse, fréquence cardiaque rapide et pouls faible, refroidissement de la peau, sensations vertigineuses et potentiellement collapsus.
Quand ces signes ou symptômes apparaissent, c'est en général très rapidement après l'injection alors que la personne atteinte se trouve encore à la clinique ou au cabinet du médecin.
Si un de ces symptômes apparait après que vous ayez quitté le lieu où l'injection vous a été administrée, vous devez IMMEDIATEMENT consulter un médecin.- Maladie sérique :
·douleurs articulaires, éruptions cutanées, ganglions lymphatiques augmentés et sensation de malaise général.
Quand ces symptômes apparaissent, c'est en général 2-4 semaines après avoir reçu le vaccin.
Si ces symptômes apparaissent vous devez consulter un médecin aussi vite que possible.Réactions très fréquentes (pouvant toucher plus d'1 personne sur 10)
·douleur dans la zone où le vaccin a été injecté, persistant quelquefois plus de trois jours. La douleur peut être sévère chez jusqu'à 1 personne sur 10 (fréquent),
·rougeur, gonflement et durcissement de la zone où le vaccin a été injecté. Le gonflement et le durcissement peuvent être sévères chez jusqu'à 1 personne sur 10 (fréquent),
·maux de tête,
·sensation de faiblesse,
·sensation de malaise général,
·douleurs musculaires.
Réactions fréquentes (pouvant toucher jusqu'à 1 personne sur 10)
·nausées,
·diarrhée,
·douleurs articulaires,
·fièvre (température élevée).
Réactions peu fréquentes (pouvant toucher jusqu'à 1 personne sur 100)
·démangeaisons de la peau,
·éruptions,
·sensations vertigineuses.
Réactions très rares (pouvant toucher jusqu'à 1 personne sur 10 000)
·bosse au site d'injection.
Réactions de fréquence indéterminée (la fréquence ne peut être estimée sur la base des données disponibles)
·aggravation de l’asthme chez les personnes qui en souffrent,
·évanouissement en réponse à l'injection,
·sensation d’engourdissement ou de picotements de la peau,
·éruptions qui sont parfois gonflées et qui démangent,
·vomissements, douleurs à l’estomac,
·modifications des analyses sanguines mesurant l’activité du foie.
Déclaration des effets secondaires
Si vous ressentez un quelconque effet indésirable, parlez-en à votre médecin, votre pharmacien ou à votre infirmier/ère. Ceci s’applique aussi à tout effet indésirable qui ne serait pas mentionné dans cette notice. Vous pouvez également déclarer les effets indésirables directement via le système national de déclaration : Agence nationale de sécurité du médicament et des produits de santé (ANSM) et réseau des Centres Régionaux de Pharmacovigilance - Site internet: www.signalement-sante.gouv.fr
En signalant les effets indésirables, vous contribuez à fournir davantage d’informations sur la sécurité du médicament.
Tenir ce médicament hors de la vue et de la portée des enfants.
N'utilisez pas ce vaccin après la date de péremption indiquée sur la boîte et sur l'étiquette de la seringue après EXP. La date de péremption fait référence au dernier jour de ce mois.
A conserver au réfrigérateur (entre 2°C et 8°C). Ne pas congeler. Conserver le vaccin dans l'emballage extérieur à l'abri de la lumière.
N’utilisez pas ce médicament si vous remarquez qu'il contient des particules étrangères.
Ne jetez aucun médicament au tout-à-l’égout ou avec les ordures ménagères. Demandez à votre pharmacien d’éliminer les médicaments que vous n’utilisez plus. Ces mesures contribueront à protéger l’environnement.
6. CONTENU DE L’EMBALLAGE ET AUTRES INFORMATIONS
Ce que contient TYAVAX, suspension et solution pour suspension injectable en seringue préremplie
- Les substances actives sont :
Virus de l'hépatite A, souche GBM1 (inactivé) 2............................................................................................................. 160 unités antigène
1 produit sur cellules diploïdes humaines MRC-5
2 adsorbé sur de l'hydroxyde d'aluminium hydraté (0,3 milligrammes d'Al)
L'hydroxyde d'aluminium est inclus dans le vaccin en tant qu'adsorbant. Les adsorbants sont des substances incluses dans certains vaccins pour accélérer, améliorer et/ou prolonger l'effet protecteur de ce vaccin.
Polyosides capsulaires Vi de Salmonella typhi (souche Ty2).................................... 25 microgrammes
·Les autres composants sont : chlorure de sodium, phosphate disodique dihydraté, phosphate monosodique dihydraté, 2-phénoxyéthanol, éthanol, formaldéhyde, milieu 199 Hanks sans rouge de phénol (mélange d'acides aminés comprenant phénylalanine (voir rubrique 2), sels minéraux (incluant le potassium), vitamines et autres composants) supplémenté avec du polysorbate 80, et eau pour préparations injectables.
Toutes les présentations ne sont pas commercialisées.
Le vaccin hépatite A inactivé est une suspension blanche, trouble, et le vaccin typhoïdique polyosidique est une solution claire, incolore.
Titulaire de l’autorisation de mise sur le marché
SANOFI PASTEUR EUROPE14 ESPACE HENRY VALLÉE
69007 LYON
FRANCE
Exploitant de l’autorisation de mise sur le marché
SANOFI PASTEUR EUROPE14 ESPACE HENRY VALLÉE
69007 LYON
FRANCE
SANOFI PASTEUR14 ESPACE HENRY VALLÉE
69007 LYON
FRANCE
Noms du médicament dans les Etats membres de l'Espace Economique Européen
Ce médicament est autorisé dans les Etats membres de l'Espace Economique Européen sous les noms suivants : Conformément à la réglementation en vigueur.[à compléter ultérieurement par le titulaire]
La dernière date à laquelle cette notice a été révisée est :
[à compléter ultérieurement par le titulaire]
Des informations détaillées sur ce médicament sont disponibles sur le site Internet de l’ANSM (France).
Les informations suivantes sont destinées exclusivement aux professionnels de santé:
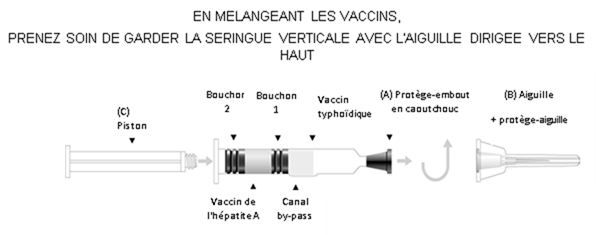
Instructions d'utilisation – seringue à double compartiment (Voir le schéma ci-après)
TYAVAX, suspension et solution pour suspension injectable en seringue préremplie
Vaccin de l'hépatite A (inactivé, adsorbé) et typhoïdique polyosidique
1. Enlever le protège embout (A).
2. Fixer l'aiguille et le protège-aiguille (B) à la seringue.
3. Visser le piston (C) dans le bouchon piston (Bouchon 2).
4. Agiter la seringue ; puis mélanger les composants du vaccin en poussant lentement le piston, en gardant l'aiguille vers le haut. Le vaccin contenu dans la chambre inférieure passe dans la chambre supérieure par le canal by-pass.
5. Agiter vigoureusement jusqu'à obtenir une suspension homogène.
6. En tenant le protège-aiguille par l'extrémité, l'enlever en tirant vers le haut sans tourner.
7. Procéder immédiatement à l'injection. Un test de retour veineux peut être réalisé en tirant légèrement sur le piston. Les bouchons peuvent se séparer mais assurez-vous que le bouchon 2 n'atteigne pas le canal by pass afin d'éviter toute perte de liquide. Si un vaisseau sanguin a été pénétré, du sang sera aspiré dans la seringue.
|
|
Voir rubrique 3. Comment utiliser TYAVAX, suspension et solution pour suspension injectable en seringue préremplie.
Retrouvez la disponibilité de votre produit dans les pharmacies:
Adresse de livraison manquante
Pour trouver la pharmacie la plus proche de chez vous, veuillez ajouter votre adresse de livraison.