ANSM - Mis à jour le : 09/08/2022
SANDOSTATINE L.P. 30 mg, poudre et solvant pour suspension injectable Octréotide Veuillez lire attentivement cette notice avant d'utiliser ce médicament car elle contient des informations importantes pour vous.· Gardez cette notice. Vous pourriez avoir besoin de la relire.
· Si vous avez d'autres questions, interrogez votre médecin, votre pharmacien ou votre infirmier/ère.
· Ce médicament vous a été personnellement prescrit. Ne le donnez pas à d'autres personnes. Il pourrait leur être nocif, même si les signes de leur maladie sont identiques aux vôtres.
· Si vous ressentez un quelconque effet indésirable, parlez-en à votre médecin, votre pharmacien ou votre infirmier/ère. Ceci s'applique aussi à tout effet indésirable qui ne serait pas mentionné dans cette notice. Voir rubrique 4.
2. Quelles sont les informations à connaître avant d'utiliser SANDOSTATINE L.P. 30 mg, poudre et solvant pour suspension injectable ?
3. Comment utiliser SANDOSTATINE L.P. 30 mg, poudre et solvant pour suspension injectable ?
4. Quels sont les effets indésirables éventuels ?
5. Comment conserver SANDOSTATINE L.P. 30 mg, poudre et solvant pour suspension injectable ?
6. Contenu de l'emballage et autres informations.
Sandostatine L.P. est un dérivé synthétique de la somatostatine, substance normalement présente dans l'organisme, et qui diminue l'effet de certaines hormones, comme l'hormone de croissance. L'avantage de Sandostatine L.P. par rapport à la somatostatine est que ce produit est plus puissant et que son effet se maintient plus longtemps.Sandostatine L.P. est utilisé :·pour traiter l'acromégalie,
L'acromégalie est une affection dans laquelle l'organisme fabrique trop d'hormone de croissance. Normalement, l'hormone de croissance contrôle la croissance des tissus, des organes et des os. Un excès d'hormone de croissance entraîne une augmentation de la taille des os et des tissus, essentiellement au niveau des mains et des pieds. Sandostatine L.P. diminue de façon marquée les symptômes de l'acromégalie tels que maux de tête, transpiration excessive, sensation d'engourdissement des mains et des pieds, fatigue et douleurs articulaires. Dans la plupart des cas, la production excessive d'hormone de croissance est due à une augmentation de la taille de l'hypophyse (adénome hypophysaire) ; le traitement par Sandostatine L.P. peut réduire la taille de l'adénome.
Sandostatine L.P. est utilisé pour traiter les patients atteints d'acromégalie :
olorsque les autres traitements de l'acromégalie (chirurgie ou radiothérapie) ne sont pas appropriés ou sont inefficaces ;
oaprès une radiothérapie, pour couvrir la période intermédiaire jusqu'à ce que la radiothérapie devienne pleinement efficace.
- pour soulager les symptômes associés à une production excessive par l'estomac, l'intestin ou le pancréas de certaines hormones et autres substances
Certaines maladies rares de l'estomac, de l'intestin ou du pancréas sont responsables d'une production excessive de certaines hormones et d'autres substances naturelles. Cela perturbe l'équilibre hormonal naturel de l'organisme, ce qui entraîne divers symptômes tels que bouffées de chaleur avec rougeurs cutanées, diarrhée, baisse de la pression artérielle, éruption cutanée et perte de poids. Le traitement par Sandostatine L.P. aide à contrôler ces symptômes.
- pour le traitement des tumeurs neuroendocrines situées dans l'intestin (par ex. : dans l'appendice, l'intestin grêle ou le côlon)
Les tumeurs neuroendocrines sont des tumeurs rares qui peuvent être situées dans différentes parties du corps. Sandostatine L.P. est également utilisé pour contrôler la croissance de ces tumeurs lorsqu'elles sont situées dans l'intestin (par ex. : appendice, intestin grêle ou colon).
- pour traiter les tumeurs hypophysaires qui produisent trop d'hormone de stimulation de la thyroïde (TSH).
Trop d'hormone de stimulation de la thyroïde (TSH) entraine une hyperthyroïdie. Sandostatine L.P. est utilisé pour traiter les personnes atteintes de tumeurs hypophysaires qui produisent trop d'hormone de stimulation de la thyroïde (TSH) :
olorsque d'autres types de traitement (chirurgie ou radiothérapie) ne conviennent pas ou n'ont pas fonctionné ;
oaprès radiothérapie, pour couvrir la période transitoire jusqu'à ce que la radiothérapie soit pleinement efficace.
Veuillez lire les explications suivantes avant d'utiliser Sandostatine L.P.
N'utilisez jamais SANDOSTATINE L.P. 30 mg, poudre et solvant pour suspension injectable :·si vous êtes allergique à l'octréotide ou à l'un des autres composants contenus dans ce médicament, mentionnés dans la rubrique 6.
Avertissements et précautionsAdressez-vous à votre médecin avant d'utiliser Sandostatine L.P. :
·si vous savez que vous avez actuellement ou avez eu par le passé des calculs biliaires ou que vous avez des complications comme de la fièvre, des frissons, des douleurs abdominales ou un jaunissement de la peau ou des yeux, parlez-en à votre médecin, car une utilisation prolongée de Sandostatine L.P. peut favoriser la formation de calculs biliaires. Votre médecin pourra décider de contrôler votre vésicule biliaire régulièrement.
·si vous savez que vous êtes diabétique, car Sandostatine L.P. peut modifier vos taux de sucre dans le sang. Si vous êtes diabétique, vos taux de sucre doivent être contrôlés régulièrement.
·si vous avez eu dans le passé une carence en vitamine B12, votre médecin pourra décider de contrôler votre taux de vitamine B12 régulièrement.
Bilans et contrôlesSi vous êtes traité(e) par Sandostatine L.P. pendant une période prolongée, votre médecin pourra décider de contrôler le fonctionnement de votre thyroïde régulièrement.
Votre médecin contrôlera le fonctionnement de votre foie.
Votre médecin peut souhaiter vérifier votre fonction enzymatique pancréatique.
EnfantsLes données relatives à l'utilisation de Sandostatine L.P. chez l'enfant sont limitées.
Autres médicaments et SANDOSTATINE L.P. 30 mg, poudre et solvant pour suspension injectableInformez votre médecin ou votre pharmacien si vous utilisez, avez récemment utilisé ou pourriez utiliser tout autre médicament.
Vous pourrez généralement continuer à prendre vos autres médicaments pendant votre traitement par Sandostatine L.P. Cependant, des modifications de l'effet de certains médicaments, tels que la cimétidine, la ciclosporine, la bromocriptine, la quinidine et la terfénadine ont été rapportées au cours du traitement par Sandostatine L.P.
Si vous prenez un médicament pour contrôler votre tension artérielle (par ex. un bêta-bloquant ou un inhibiteur calcique) ou un médicament destiné à contrôler l'équilibre hydro-électrolytique, votre médecin pourra être amené à adapter la dose que vous devez prendre.
Si vous êtes diabétique, votre médecin pourra être amené à adapter votre dose d'insuline.
Si vous êtes sur le point de recevoir du lutécium (177Lu) oxodotréotide, un traitement radiopharmaceutique, votre médecin pourra arrêter et/ou adapter votre traitement par Sandostatine L.P. pendant une courte période.
SANDOSTATINE L.P. 30 mg, poudre et solvant pour suspension injectable avec des aliments, boissons et de l'alcoolSans objet.
Grossesse, allaitement et fertilitéSi vous êtes enceinte ou que vous allaitez, si vous pensez être enceinte ou planifiez une grossesse, demandez conseil à votre médecin avant de prendre ce médicament.
Sandostatine L.P. ne doit être utilisé pendant la grossesse que si ce traitement est vraiment indispensable.
Les femmes en âge de procréer doivent utiliser une contraception efficace pendant le traitement.
N'allaitez pas pendant le traitement par Sandostatine L.P. On ne sait pas si Sandostatine L.P. passe dans le lait maternel.
Conduite de véhicules et utilisation de machinesSandostatine L.P. n'a aucune influence ou une influence négligeable sur l'aptitude à conduire des véhicules et à utiliser des machines. Cependant, certains des effets indésirables que vous pourriez ressentir au cours du traitement par Sandostatine L.P., tels que des maux de tête et de la fatigue, pourraient diminuer votre aptitude à conduire des véhicules et à utiliser des machines.
SANDOSTATINE L.P. 30 mg, poudre et solvant pour suspension injectable contient du sodiumSandostatine L.P. contient moins de 1 mmol de sodium (23 mg) par dose, c'est-à-dire qu'il est essentiellement « sans sodium ».
3. COMMENT UTILISER SANDOSTATINE L.P. 30 mg, poudre et solvant pour suspension injectable ?
Si vous avez utilisé plus de SANDOSTATINE L.P. 30 mg, poudre et solvant pour suspension injectable que vous n'auriez dûAucune réaction pouvant mettre en jeu la vie du patient n'a été déclarée après un surdosage de Sandostatine L.P.
Les symptômes d'un surdosage sont les suivants : bouffées de chaleur, besoin fréquent d'uriner, fatigue, dépression, anxiété et manque de concentration.
Si vous pensez subir les effets d'un surdosage et ressentez ces symptômes, consultez immédiatement votre médecin.
Si vous oubliez d'utiliser SANDOSTATINE L.P. 30 mg, poudre et solvant pour suspension injectable Si vous arrêtez d'utiliser SANDOSTATINE L.P. 30 mg, poudre et solvant pour suspension injectableSi vous interrompez votre traitement par Sandostatine L.P., les symptômes peuvent réapparaître. Par conséquent, vous ne devez pas arrêter d'utiliser Sandostatine L.P. à moins que votre médecin ne vous l'ait demandé.
Si vous avez d'autres questions sur l'utilisation de ce médicament, demandez plus d'informations à votre médecin, à votre pharmacien ou à votre infirmier/ère.
4. QUELS SONT LES EFFETS INDESIRABLES EVENTUELS ?
Certains effets indésirables peuvent être graves. Prévenez immédiatement votre médecin si vous présentez l'un des effets indésirables suivants :Très fréquent (peut affecter plus d'1 personne sur 10) :
- Calculs biliaires, entraînant une douleur brutale dans le dos.
·Taux de sucre dans le sang trop élevé.
Fréquent (peut affecter jusqu'à 1 personne sur 10) :
- Thyroïde insuffisamment active (hypothyroïdie) entraînant une modification du rythme cardiaque, de l'appétit ou du poids ; fatigue, sensation de froid, ou gonflement de la gorge.
- Résultats anormaux lors des contrôles du fonctionnement de la thyroïde.
- Inflammation de la vésicule biliaire (cholécystite) ; les symptômes peuvent inclure une douleur abdominale en haut à droite, de la fièvre, des nausées, un jaunissement de la peau et des yeux (jaunisse).
- Taux de sucre dans le sang trop faible.
- Altération de la tolérance au glucose.
·Rythme cardiaque lent.
Peu fréquent (peut affecter jusqu'à 1 personne sur 100) :
- Soif, faible quantité d'urines, urines foncées, sécheresse et rougeur de la peau.
·Rythme cardiaque rapide.
Autres effets indésirables graves- Réactions d'hypersensibilité (allergie), notamment éruption cutanée.
·Anaphylaxie : type de réaction allergique pouvant entraîner des difficultés à avaler ou à respirer, un gonflement et des picotements, possiblement avec une chute de la pression artérielle et des vertiges ou une perte de conscience.
- Inflammation du pancréas (pancréatite) ; les symptômes peuvent inclure une douleur soudaine en haut de l'abdomen, des nausées, des vomissements et des diarrhées.
- Inflammation du foie (hépatite) ; les symptômes sont notamment un jaunissement de la peau et des yeux (jaunisse), des nausées, des vomissements, une perte d'appétit, un sentiment général de malaise, des démangeaisons et des urines claires.
·Rythme cardiaque irrégulier.
· Faible taux de plaquettes dans le sang ; cela pourrait entraîner une augmentation des saignements ou des ecchymoses.
Prévenez immédiatement votre médecin si vous remarquez l'un des effets indésirables mentionnés ci-dessus.
Autres effets indésirablesPrévenez votre médecin, votre pharmacien ou votre infirmier/ère si vous remarquez l'un des effets indésirables mentionnés ci-dessous. Ils sont généralement sans gravité et ont tendance à disparaître au cours du traitement.
Très fréquent (peut affecter plus d'1 personne sur 10) :
- Diarrhée.
- Douleurs abdominales.
- Nausées.
- Constipation.
- Flatulences (gaz).
- Céphalées.
·Douleur localisée au site d'injection.
Fréquent (peut affecter jusqu'à 1 personne sur 10) :
- Inconfort au niveau de l'estomac après les repas (dyspepsie).
- Vomissements.
- Sensation de plénitude de l'estomac.
- Selles grasses.
- Selles molles.
- Selles décolorées.
- Sensation vertigineuse.
- Perte d'appétit.
- Résultats anormaux lors des contrôles du fonctionnement du foie.
- Chute de cheveux.
- Essoufflement.
·Faiblesse.
Si vous ressentez un quelconque effet indésirable, parlez-en à votre médecin, votre infirmier(e) ou votre pharmacien.
Déclaration des effets secondaires
Si vous ressentez un quelconque effet indésirable, parlez-en à votre médecin, votre pharmacien ou votre infirmier/ère. Ceci s'applique aussi à tout effet indésirable qui ne serait pas mentionné dans cette notice. Vous pouvez également déclarer les effets indésirables directement via le système national de déclaration : Agence nationale de sécurité du médicament et des produits de santé (ANSM) et réseau des Centres Régionaux de Pharmacovigilance - Site internet : www.signalement-sante.gouv.fr
En signalant les effets indésirables, vous contribuez à fournir davantage d'informations sur la sécurité du médicament.
5. COMMENT CONSERVER SANDOSTATINE L.P. 30 mg, poudre et solvant pour suspension injectable ?
Tenir ce médicament hors de la vue et de la portée des enfants.
A conserver dans l'emballage d'origine, à l'abri de la lumière.
A conserver au réfrigérateur (2°C à 8°C). Ne pas congeler.
Sandostatine L.P peut être conservé à une température ne dépassant pas 25°C le jour de l'injection.
Ne pas conserver Sandostatine L.P. après reconstitution (il doit être utilisé immédiatement)
N'utilisez pas ce médicament après la date de péremption indiquée sur l'étiquette et l'étui après « EXP ». La date de péremption fait référence au dernier jour de ce mois.
N'utilisez pas ce médicament si vous remarquez des particules ou un changement de couleur.
Ne jetez aucun médicament au tout-à-l'égout ni avec les ordures ménagères. Demandez à votre pharmacien d'éliminer les médicaments que vous n'utilisez plus. Ces mesures contribueront à protéger l'environnement
6. CONTENU DE L'EMBALLAGE ET AUTRES INFORMATIONS
Ce que contient SANDOSTATINE L.P. 30 mg, poudre et solvant pour suspension injectable
·La substance active est : octréotide
Un flacon contient 30 mg d'octréotide (sous forme acétate d'octréotide)
·Les autres composants sont :
Dans la poudre (en flacon) : poly (DL-lactide-co-glycolide), mannitol (E421)
Dans le solvant (en seringue préremplie) : carmellose sodique, mannitol (E421), poloxamer 188, eau pour préparations injectables.
Les conditionnements unitaires contiennent un flacon de verre de 6 mL, fermé par un bouchon (en caoutchouc bromobutyle) scellé par une capsule d'aluminium, contenant la poudre pour suspension injectable et une seringue préremplie en verre incolore de 3 mL avec un bouchon à l'avant et un autre côté piston (en caoutchouc chlorobutyle) avec 2 mL de solvant, conditionnés ensemble dans une barquette scellée avec un adaptateur pour flacon et une aiguille d'injection sécurisée.
Les conditionnements multiples sont composés de trois conditionnements unitaires, chaque conditionnement unitaire contenant : un flacon de verre de 6 mL, fermé par un bouchon (en caoutchouc bromobutyle) scellé par une capsule d'aluminium, contenant la poudre pour suspension injectable et une seringue préremplie en verre incolore de 3 mL avec un bouchon à l'avant et un autre côté piston (en caoutchouc chlorobutyle) avec 2 mL de solvant, conditionnés ensemble dans une barquette scellée avec un adaptateur pour flacon et une aiguille d'injection sécurisée.
Toutes les présentations peuvent ne pas être commercialisées.
Titulaire de l'autorisation de mise sur le marché
NOVARTIS PHARMA S.A.S.8-10 RUE HENRI SAINTE-CLAIRE DEVILLE
92500 RUEIL-MALMAISON
Exploitant de l'autorisation de mise sur le marché
NOVARTIS PHARMA S.A.S.8-10 RUE HENRI SAINTE-CLAIRE DEVILLE
92500 RUEIL-MALMAISON
NOVARTIS PHARMA S.A.S.8-10 RUE HENRI SAINTE-CLAIRE DEVILLE
92500 RUEIL-MALMAISON
FRANCE
NOVARTIS PHARMA GMBHJAKOV-LIND-STRASSE 5, TOP 3.05 1020 WIEN
AUTRICHE
NOVARTIS PHARMA NVMEDIALAAN 40/BUS 1
1800 VILVOORDE
BELGIQUE
NOVARTIS HEALTHCARE A/SEDVARD THOMSENS VEJ 14
DK-2300 COPENHAGEN S
DANEMARK
NOVARTIS FINLAND OYMETSÄNNEIDONKUJA 10
02130 ESPOO
FINLANDE
NOVARTIS FARMA - PRODUTOS FARMACEUTICOS S.A.AVENIDA PROFESSOR DOUTOR CAVACO SILVA,
N.º 10E TAGUSPARK,
2740-255 PORTO SALVO
PORTUGAL
NOVARTIS FARMA S.P.A.VIA PROVINCIALE SCHITO 131
80058 TORRE ANNUNZIATA, NA
ITALIE
NOVARTIS FARMACEUTICA SAGRAN VIA DE LES CORTS CATALANES, 764
08013 BARCELONA
ESPAGNE
NOVARTIS SVERIGE AB,TORSHAMNSGATAN 48
164 40 KISTA
SUEDE
NOVARTIS (HELLAS) SA12TH KM NATIONAL ROAD ATHINON-LAMIAS
METAMORFOSI ATTIKI, 14451
GRECE
NOVARTIS PHARMA B.V.HAAKSBERGWEG 16
1101 BX AMSTERDAM
PAYS-BAS
NOVARTIS PHARMA GMBHROONSTRASSE 25
90429 NÜRNBERG
ALLEMAGNE
NOVARTIS PHARMACEUTICALS UK LIMITED2ND FLOOR, THE WESTWORKS BUILDING, WHITE CITY PLACE
195 WOOD LANE
LONDON, W12 7FQ
ROYAUME-UNI
DEMETRIADES & PAPAELLINAS LTD179 GIANNOS KRANIDIOTIS AVENUE,
2235, LATSIA, P.O.BOX 24018,
NICOSIA, 1700,
CHYPRE
NOVARTIS S.R.O.NA PANKRACI 1724/129
140 00 PRAHA 4 NUSLE
REPUBLIQUE TCHEQUE
NOVARTIS HUNGARY LTD.VASΎT U.13.
BUDAÖRS, 2040
HONGRIE
NOVARTIS NORGE ASNYDALEN ALLE 37 A,
NO-0484 OSLO
NORVEGE
NOVARTIS FARMA S.P.A.LARGO UMBERTO BOCCIONI
1 - 21040 ORIGGIO (VA)
ITALIE
NOVARTIS POLAND SP. Z O.O.15 MARYNARSKA STREET,
02-674 WARSAW
POLOGNE
Noms du médicament dans les Etats membres de l'Espace Economique Européen
Ce médicament est autorisé dans les Etats membres de l'Espace Economique Européen et au Royaume-Uni (Irlande du Nord) sous les noms suivants :[À compléter ultérieurement par le titulaire]
La dernière date à laquelle cette notice a été révisée est :
[à compléter ultérieurement par le titulaire]
Des informations détaillées sur ce médicament sont disponibles sur le site Internet de l'ANSM (France).
Les informations suivantes sont destinées exclusivement aux professionnels de santé :
Dose de SANDOSTATINE L.P. 30 mg, poudre et solvant pour suspension injectable à utiliserAcromégalie
Il est recommandé de débuter le traitement par Sandostatine L.P. à la posologie de 20 mg toutes les 4 semaines pendant 3 mois. Chez les patients sous traitement par Sandostatine par voie sous-cutanée (s.c.), le traitement avec Sandostatine L.P. peut être initié le lendemain de la dernière administration de Sandostatine s.c. L'ajustement de la dose sera basé sur les taux sériques de l'hormone de croissance (GH) et de l'IGF-1 /Somatomédine C, ainsi que sur les symptômes cliniques.
Si après 3 mois de traitement, les symptômes cliniques et les taux hormonaux (GH ; IGF-1) ne sont pas complètement contrôlés (concentration de GH toujours > 2,5 microgrammes/L), la dose de Sandostatine L.P. peut être augmentée à 30 mg administrée toutes les 4 semaines. Si trois mois plus tard, les concentrations de GH et d'IGF-1 ne sont pas suffisamment contrôlées par l'administration de 30 mg de Sandostatine L.P., la dose peut être augmentée à 40 mg toutes les 4 semaines.
Chez les patients dont le taux de GH se maintient, toujours, au-dessous de 1 microgramme/L, dont le taux d'IGF-1 est normalisé et chez qui les principaux signes/symptômes réversibles de l'acromégalie ont disparu après 3 mois de traitement à la dose de 20 mg, il est possible de réduire la dose à 10 mg de Sandostatine L.P. toutes les 4 semaines. Néanmoins, chez ces patients qui reçoivent de faibles doses de Sandostatine L.P., il est recommandé une surveillance stricte des valeurs sériques de GH et d'IGF-1 et des signes / symptômes cliniques.
Pour les patients qui sont traités par une dose stable de Sandostatine L.P., un dosage des taux de GH et d'IGF-1 doit être réalisé tous les 6 mois.
Tumeurs endocrines gastro-entéro-pancréatiques
· Traitement des patients présentant des symptômes associés aux tumeurs neuroendocrines gastro-entéro-pancréatiques fonctionnelles
Il est recommandé de débuter le traitement par Sandostatine L.P. à la posologie de 20 mg toutes les 4 semaines. Chez les patients sous traitement par Sandostatine par voie sous-cutanée (s.c.), l'administration de Sandostatine (s.c.) doit être poursuivie, pendant les 2 semaines qui suivent la première injection de Sandostatine L.P. à la même posologie efficace que précédemment.
Chez les patients dont les symptômes et les marqueurs biologiques sont bien contrôlés après 3 mois de traitement, la posologie peut être réduite à 10 mg de Sandostatine L.P. toutes les 4 semaines.
Chez les patients dont les symptômes ne sont que partiellement contrôlés après 3 mois de traitement, la posologie peut être augmentée à 30 mg de Sandostatine L.P. toutes les 4 semaines.
Durant les périodes où les symptômes liés aux tumeurs neuroendocrines gastro-entéro-pancréatiques pourraient se majorer pendant le traitement par Sandostatine L.P., il est recommandé d'administrer simultanément Sandostatine par voie sous-cutanée à la dose qui était pratiquée avant l'instauration du traitement par Sandostatine L.P. Cela peut se produire principalement au cours des 2 premiers mois de traitement jusqu'à l'atteinte des concentrations thérapeutiques efficaces d'octréotide.
· Traitement des patients atteints de tumeurs neuroendocrines avancées de l'intestin moyen ou de localisation primitive inconnue lorsque les sites primitifs ne correspondant pas à l'intestin moyen ont été exclus.
La dose recommandée de Sandostatine L.P. est de 30 mg toutes les 4 semaines. Le traitement par Sandostatine L.P. dans le but de contrôler les tumeurs doit être poursuivi en l'absence de progression tumorale.
Adénomes thyréotropes
Le traitement par Sandostatine L.P. doit débuter à la posologie de 20 mg toutes les 4 semaines pendant 3 mois avant d'envisager une adaptation posologique. La dose sera adaptée en fonction de la réponse de la TSH et des hormones thyroïdiennes.
Instructions relatives à la préparation et à l'administration intramusculaire de Sandostatine L.P.
POUR INJECTION INTRAMUSCULAIRE PROFONDE SEULEMENT
Le kit d'injection comprend :

a. un flacon contenant la poudre de Sandostatine L.P.
b. une seringue préremplie contenant le solvant de reconstitution
c. un adaptateur pour flacon pour la reconstitution du produit
d. une aiguille d'injection sécurisée
Les instructions ci-dessous doivent être suivies avec attention afin de garantir la bonne reconstitution de Sandostatine L.P. avant son administration intramusculaire profonde.
Il y a 3 étapes critiques lors de la reconstitution de la suspension de Sandostatine L.P. Ne pas les respecter peut empêcher la bonne administration du produit.
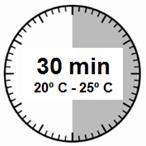
· Le kit d'injection doit être à température ambiante. Sortir le kit d'injection du réfrigérateur et le laisser à température ambiante pendant au-moins 30 minutes avant la reconstitution, mais sans dépasser 24 heures.
· Après avoir ajouté le solvant dans le flacon, laisser reposer ce dernier pendant 5 minutes pour laisser la poudre s'humidifier totalement.
· Après humidification, secouer modérément le flacon à l'horizontale pendant 30 secondes minimum jusqu'à la formation d'une suspension homogène. La suspension de Sandostatine L.P. doit être préparée immédiatement avant l'administration.
Sandostatine L.P. doit être administrée exclusivement par un personnel de santé entraîné.
|
Etape 1 ·Sortir le kit d'injection Sandostatine L.P. du réfrigérateur. ATTENTION : il est essentiel de commencer la reconstitution une fois que le kit d'injection est revenu à température ambiante. Pour cela, laisser le kit à température ambiante pendant un minimum de 30 minutes avant la reconstitution, mais sans dépasser 24 heures. Remarque : le kit d'injection peut être remis au réfrigérateur si nécessaire. |
|
|
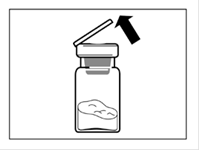
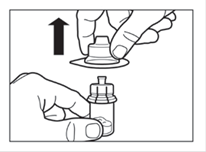
Etape 2 ·Retirer l'opercule de plastique du flacon et désinfecter le bouchon de caoutchouc du flacon avec un tampon alcoolisé · Retirez le film couvrant l'adaptateur du flacon, mais NE PAS sortir l'adaptateur de son conditionnement. ·En le tenant par son conditionnement, poser l'adaptateur sur le dessus du flacon et le pousser vers le bas de telle sorte qu'il se fixe en laissant entendre un « clic ». · Retirer le conditionnement de l'adaptateur par un mouvement vertical. |
|
|
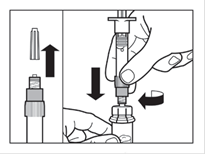
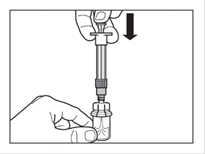
Etape 3 · Retirer le capuchon de la seringue préremplie de solvant et visser la seringue sur l'adaptateur du flacon. · Poussez lentement le piston jusqu'en bas pour transférer tout le solvant dans le flacon. |
|
|
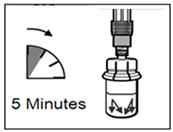
Etape 4 ATTENTION : il est essentiel de laisser le flacon reposer pendant 5 minutes afin de s'assurer que le solvant a complètement humidifié la poudre. Remarque: il est normal que le piston remonte car il peut y avoir une légère surpression dans le flacon. · A ce stade, préparer le patient pour l'injection. |
|
|
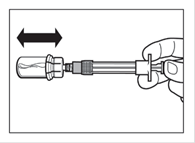
Etape 5 · Après la période d'humidification, s'assurer de bien repousser le piston jusqu'en bas de la seringue. ATTENTION: Maintenir le piston appuyé et secouer le flacon modérément à l'horizontale pendant minimum 30 secondes de telle sorte que la poudre soit complètement mise en suspension (suspension laiteuse homogène). Secouer de nouveau modérément pendant 30 secondes si la poudre n'est pas complètement mise en suspension. |
|
|
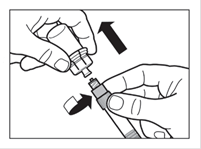
Etape 6 ·Préparer le site d'injection avec un tampon alcoolisé. ·Retourner la seringue et le flacon tête en bas, tirer doucement le piston et aspirer entièrement le contenu du flacon dans la seringue. ·Dévisser la seringue de l'adaptateur. |
|
|
Etape 7 · Vissez l'aiguille d'injection sécurisée sur la seringue. · Agiter de nouveau la seringue doucement pour s'assurer d'une suspension laiteuse homogène. · Retirer le capuchon protecteur de l'aiguille d'injection. · Tapoter doucement la seringue pour éliminer les bulles visibles et les chasser hors de la seringue. Vérifier que le site d'injection n'a pas été contaminé. · Procéder immédiatement à l'étape 8 pour l'administration au patient. Tout retard peut entraîner une sédimentation. |
|
|
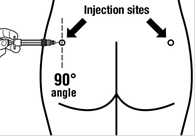
Etape 8 ·Sandostatine L.P. doit être injecté exclusivement par voie intramusculaire profonde ; JAMAIS par voie intraveineuse. ·Piquer l'aiguille profondément dans le muscle fessier gauche ou droit avec un angle de 90º par rapport à la peau. ·Tirer lentement le piston pour vérifier qu'aucun vaisseau n'a été touché (repiquer si un vaisseau a été touché). ·Pousser lentement le piston jusqu'à ce que la seringue soit vide. Retirer l'aiguille du point d'injection et utiliser le dispositif de sécurité (comme expliqué à l'étape 9). |
|
|
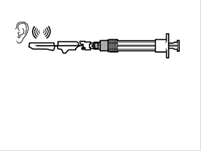
Etape 9
osoit presser la charnière du volet de sécurité à plat sur une surface rigide (figure A) osoit pousser la charnière en avant avec le doigt (figure B). ·Un clic sonore confirme la mise en place correcte. ·Jeter immédiatement la seringue (dans un container adapté). |
|
Retrouvez la disponibilité de votre produit dans les pharmacies:
Adresse de livraison manquante
Pour trouver la pharmacie la plus proche de chez vous, veuillez ajouter votre adresse de livraison.